ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
จากตัวอย่างการคำนวณหาอัตราการเกิดปฏิกิริยาเคมีของสารในช่วงเวลาต่าง ๆ โดยใช้ข้อมูลในตาราง 6.1 และพิจารณาจากความชันของกราฟ ทำให้ทราบว่าปฏิกิริยาเกิดขึ้นเร็วในช่วงแรกหรือเมื่อเริ่มเกิดปฏิกิริยา และจะเกิดช้าลงเมื่อเวลาผ่านไป นักเรียนคิดว่าเป็นเพราะเหตุใด และมีปัจจัยใดบ้างที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
6.4.1 ความเข้มข้นของสารกับอัตราการเกิดปฏิกิริยาเคมี
จากการศึกษาอัตราการสลายตัวของไดไนโตรเจนเพนตะออกไซด์ในช่วงเวลาต่าง ๆ ดังแสดงในตาราง 6.2 พบว่าเมื่อเวลาผ่านไปอัตราการเกิดปฏิกิริยาเคมีมีค่าลดลงนักเรียนคิดว่าเป็นผลมาจากความเข้มข้นของสารตั้งต้นลดลงหรือไม่ เพื่อตรวจสอบว่าความเข้มข้นของสารมีผลต่ออัตราการเกิดปฏิกิริยาเคมีหรือไม่ ให้นักเรียนศึกษาจากการทดลองต่อไปนี้
การทดลอง 6.2 ความเข้มข้นของสารกับอัตราการเกิดปฏิกิริยาเคมี
ตอนที่ 1 ใช้สารละลายโซเดียมไทโอซัลเฟตที่มีความเข้มข้นต่างกันทำปฏิกิริยากับสารละลายกรดไฮโดรคลอริกที่มีความเข้มข้นคงที่
1. รินสารละลายกรดไฮโดรคลอริด 3

จำนวน 10

ลงในหลอดทดลองขนาดใหญ่
2. นำกระดาษสีขาวที่ทำเครื่องหมายกากบาทไว้มาวางชิดข้างหลอดทดลองด้านหนึ่ง โดยให้เครื่องหมายกากบาทอยู่สูงจากก้นหลอดประมาณ 2.5 cm
3. เติมสารละลายโซเดียมไทโอซัลเฟต 0.3

จำนวน 10

ลงในหลอดทดลองในข้อ 1 เขย่าให้เข้ากัน สังเกตเครื่องหมายและจับเวลาผสมสารละลายเข้าด้วยกันจนกระทั่งเริ่มมองไม่เห็นเครื่องหมายกากบาท
4. ทำการทดลองอีก 4 ครั้ง โดยใช้โซเดียมไทโอซัลเฟตผสมกับน้ำกลั่นตามปริมาตรที่กำหนดให้ในตาราง แต่ใช้ปริมาตรของกรดไฮโดรคลอริกเท่าเดิม
ตารางกำหนดปริมาตรของสารละลายโซเดียมไทโอซัลเฟตและน้ำที่ใช้ในการทดลองตอนที่ 1
| หลอดที่ |
ปริมาตรของสารละลาย  |
ปริมาตรของน้ำ( ) ) |
1
2
3
4
5 |
10
8
6
4
2 |
0
2
4
6
8 |
ตอนที่ 2 ใช้สารละลายกรดไฮโดรคลอริกที่มีความเข้มข้นต่างกันทำปฏิกิริยากับสารละลายโซเดียมไทโอซัลเฟตที่มีความเข้มข้นคงที่
ทำการทดลองเช่นเดียวกับตอนที่ 1 แต่ใช้สารละลายกรดไอโดรคลอริกที่มีความเข้มข้น 0.3

ผสมกับน้ำกลั่นตามปริมาตรที่กำหนดในตาราง และใช้สารละลายโซเดียมไทโอซัลเฟตเข้มข้น 0.3

ปริมาตรคงที่ 10
 ตารางกำหนดปริมาตรของสารละลายกรดไฮโดรคลอริกและน้ำที่ใช้ในการทดลองตอนที่ 2
ตารางกำหนดปริมาตรของสารละลายกรดไฮโดรคลอริกและน้ำที่ใช้ในการทดลองตอนที่ 2
| หลอดที่ |
ปริมาตรของสารละลาย  |
ปริมาตรของน้ำ( ) ) |
1
2
3
4
5 |
10
8
6
4
2 |
0
2
4
6
8 |
ในการทดลองตอนที่ 1 เมื่อใส่สารละลายโซเดียมไทโอซัลเฟต 0.3

ลงในหลอดที่ 1 โดยไม่มีการเติมน้ำ ความเข้มของสารละลายในหลอดนี้ยังคงเป็น 0.3

ส่วนหลอดที่ 2 นำสารละลายโซเดียมไทโอซัลเฟต 0.3

จำนวน 8

มาเติมน้ำให้เป็น 10

ความเข้มข้นของสารละลายในหลอดคำนวณได้ดังนี้
จำนวนโมลของโซเดียมไทโอซัลเฟตในสารละลายโซเดียมไทโอซัลเฟต 0.3

จำนวน 8

เป็นดังนี้
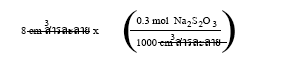
=

เมื่อเติมน้ำ 2

ทำให้สารละลายมีปริมาตรรวม 10

ความเข้มข้นของสารละลายโซเดียามไทโอซัลเฟตในหน่วย

เป็นดังนี้
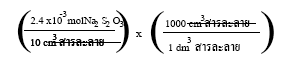
= 0.24

แสดงว่าสารละลายโซเดียมไทโอซัลเฟตในหลอดที่ 2 มีความเข้มข้น 0.24

สำหรับความเข้มข้นของสารละลายโซเดียมไทโอซัลเฟตในหลอดอื่นก็คำนวณได้ในทำนองเดียวกัน
เมื่อโซเดียมไทโอซัลเฟตทำปฏิกิริยากับกรดไฮโดรคลอริกจะเกิดปฏิกิริยา ดังสมการ
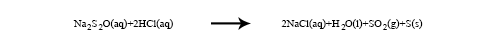
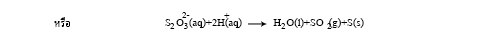
จากการทดลอง นักเรียนได้วัดระยะเวลาของการเกิดปฏิกิริยาตั้งแต่เริ่มต้นจนได้ปริมาณของกำมะถันที่เกิดขึ้นเท่ากัน คือเมื่อเริ่มมองไม่เห็นเครื่องหมายกากบาท ดังนั้นจึงกล่าวได้ว่า ปฏิกิริยาของสารในทุกหลอดเริ่มต้นจากจุดเดียวกันและดำเนินไปจนถึงจุดหมายปลายทางเดียวกัน อัตราการเกิดปฏิกิริยาเฉลี่ยเขียนแสดงได้ดังนี้
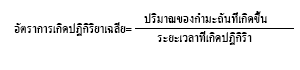
ถ้านำอัตราการเกิดปฏิกิริยาเฉลี่ยของสารในแต่ละหลอดมาเปรียบเทียบกันจะเป็นดังนี้
อัตราการเกิดปฏิกิริยาเฉลี่ยของสารในหลอดที่ 1 : อัตราการเกิดปฏิกิริยาเฉลี่ยของสารในหลอดที่ 2

เนื่องจากปริมาณของกำมะถันที่เกิดขึ้นในแต่ละหลอดเท่ากันดังนั้น
.jpg)
จากความสัมพันธ์นี้จึงกล่าวได้ว่า ถ้าต้องการเปรียบเทียบอัตราการเกิดปฏิกิริยาเฉลี่ยของสารในแต่ละหลอด อาจใช้ส่วนกลับของระยะเวลาที่สารในแต่ละหลอดเกิดปฏิกิริยามาเปรียบเทียบกันได้ สารในหลอดที่ใช้ระยะเวลาการเกิดปฏิกิริยาน้อย แสดงว่ามีอัตราการเกิดปฏิกิริยาสูงกว่าสารในหลอดที่ใช้ระยะเวลามากกว่า
จากผลการทดลอง 6.2 จะพบว่าเมื่อให้ความเข้มข้นของไฮโดรเจนไอออนคงที่ แต่เปลี่ยนความเข้มข้นของไทโอซัลเฟตไอออน อัตราการเกิดปฏิกิริยาจะเปลี่ยนไปในทำนองเดียวกันการเปลี่ยนความเข้มข้นของไฮโดรเจนไอออนโดยให้ความเข้มข้นของไทโอซัลเฟตคงที่ก็มีผลทำให้อัตราการเกิดปฏิกิริยาเปลี่ยนแปลงด้วย แสดงว่าความเข้มข้นของสารตั้งต้นทั้งสองชนิดในปฏิกิริยานี้มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
เนื่องจากการเพิ่มหรือลดความเข้มข้นของสารตั้งต้นมีความสัมพันธ์กับการเพิ่มหรือลดจำนวนอนุภาคของสารตั้งต้นในระบบ ดังนั้นในกรณีของการเพิ่มความเข้มข้นของสารตั้งต้น จะทำให้จำนวนอนุภาคของสารตั้งต้นในระบบเพิ่มขึ้น โอกาสที่อนุภาคที่มีพลังงานสูงก็มีจำนวนมากขึ้นดังรูป 6.9 และอนุภาคที่มีพลังงานสูงก๊มีจำนวนมากขึ้นด้วยด้วย จึงมีผลทำให้อัตราการเกิดปฏิกิริยามีค่าสูง
.jpg) รูป 6.9 ผลของความเข้มข้นต่อจำนวนการชนกันของอนุภาค
(ก) โมเลกุล A กับ B ชนกันได้ 4 แบบ
(ข) เมื่อเพิ่มความเข้มข้นของ A หรือ B เป็น 2 เท่าโมเลกุลจะชนกันได้ 8 แบบ
(ค) เมื่อเพิ่มความเข้มข้นของทั้ง A และ B เป็น 2 เท่าโมเลกุลจะชนกันได้ 16 แบบ
รูป 6.9 ผลของความเข้มข้นต่อจำนวนการชนกันของอนุภาค
(ก) โมเลกุล A กับ B ชนกันได้ 4 แบบ
(ข) เมื่อเพิ่มความเข้มข้นของ A หรือ B เป็น 2 เท่าโมเลกุลจะชนกันได้ 8 แบบ
(ค) เมื่อเพิ่มความเข้มข้นของทั้ง A และ B เป็น 2 เท่าโมเลกุลจะชนกันได้ 16 แบบ
โดยทั่วไปเราพบว่าการเพิ่มความเข้มข้นของสารตั้งต้นจะมีผลต่ออัตราการเกิดปฏิกิริยาเคมี อย่างไรก็ตามยังมีบางปฏิกิริยาที่อัตราการเกิดปฏิกิริยาเคมีขึ้นอยู่กับความเข้มข้นของสารตั้งต้นชนิดใดชนิดหนึ่งเท่านั้น หรือบางปฏิกิริยาอัตราการเกิดปฏิกิริยาเคมีก็ไม่ขึ้นกับความเข้มข้นของสารตั้งต้น กล่าวคืออัตราการเกิดปฏิกิริยาจะคงที่ไม่ว่าจะมีสารตั้งต้นมากหรือน้อยเพียงใด เช่น ปฏิกิริยาการกำจัดแอลกอฮอล์เข้าสู่กระแสเลือด ร่างกายจะต้องกำจัด
ออกทั้งในรูปแอลกอฮอล์โดยตรงและการสลายเป็นสารอื่น อัตราการสลายตัวของแอลกอฮอล์เป็นสารอื่นจะมีค่าคงที่ โดยไม่ขึ้นกับปริมาณของแอลกอฮอล์ในเลือดว่ามีอยู่มากน้อยเพียงใด
จากตัวอย่างที่กล่าวมาแล้ว ถ้าเราทราบชนิดของสารตั้งต้นและผลิตภัณฑ์ที่เกิดขึ้นในปฏิกิริยา เราสามารถเขียนสมการแสดงปฏิกิริยานั้นได้ แต่ไม่สามารถทำนายอัตราการเกิดปฏิกิริยาได้ว่าสูงหรือต่ำ และขึ้นอยู่กับความเข้มข้นของสารใดบ้าง ข้อมูลเหล่านี้จะต้องได้จากการทดลองเท่านั้น
6.4.2 พื้นที่ผิวของสารกับอัตรากรเกิดปฏิกิริยาเคมี
นักเรียนได้ทราบแล้วว่าความเข้มข้นของสารเป็นปัจจัยหนึ่งที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี รวมทั้งได้ศึกษาปฏิกิริยาระหว่างลวดแมกนีเซียมกับกรดไฮโดรคลอริกมาแล้วในการทดลองที่ 6.1 นักเรียนคิดว่าถ้านำลวดแมกนีเซียมที่มีมวลเท่ากันต่ามีพื้นที่ผิวไม่เท่ากันมาทำปฏิกิริยากับกรดไฮโดรคลอริก อัตราการเกิดปฏิกิริยาจะแตกต่างกันหรือไม่ อย่างไร ศึกษาได้จากการทดลองต่อไปนี้
การทดลอง 6.3 พื้นที่ผิวของสารกับอัตราการเกิดปฏิกิริยาเคมี
1.ทำการทดลองเช่นเดียวกับการทดลอง 6.1 แต่เริ่มจับเวลาเมื่อสารละลายในกระบอกตวงอยู่ที่ขีด 1

และทุก ๆ 1

จนถึงขีด 5

2. ทำการทดลองเช่นเดียวกับข้อ 1 แต่พับลวดแมกนีเซียมให้เหลือความยาวประมาณ 3 cm
จากการทดลองพบว่าแมกนีเซียมที่มีมวลเท่ากัน แต่มีพื้นที่ผิวไม่เท่ากัน มีอัตราการเกิดปฏิกิริยาแตกต่างกัน กล่าวคือ แมกนีเซียมที่มีพื้นที่ผิวมากมีอัตราการเกิดปฏิกิริยาสูงกว่าแมกนีเซียมที่มีพื้นที่ผิวน้อย ซึ่งอธิบายได้ว่าการที่สารตั้งต้นมีพื้นที่ผิวมาก มีผลให้อนุภาคของสารมีโอกาสเข้าชนกันได้มาก ปฏิกิริยาจึงเกิดได้เร็วขึ้น
6.4.3 อุณหภูมิกับอัตราการเกิดปฏิกิริยาเคมี
เมื่อวางชิ้นโลหะแมกนีเซียมไว้ในอากาศที่อุณหภูมิห้อง ผิวของโลหะจะเปลี่ยนเป็นสีเทาอย่างช้า ๆ เนื่องจากเกิดปฏิกิริยากับออกซิเจนในอากาศได้แมกนีเซียมออกไซด์ฉาบอยู่ที่ผิว แต่ถ้านำโลหะแมกนีเซียมไปเผาในอากาศจะได้ผงแมกนีเซียมออกไซด์ภายในเวลาไม่กี่นาที ทำให้ตั้งข้อสังเกตได้ว่าอุณหภูมิน่าจะเป็นอีกปัจจัยหนึ่งที่ทำให้ปฏิกิริยาเคมีเกิดเร็วหรือช้า การทดลองต่อไปนี้เป็นการศึกษาว่าการเพิ่มหรือลดอุณหภูมิมีผลต่ออัตราการเกิดปฏิกิริยาเคมีอย่างไร
การทดลอง 6.4 อัตราการเกิดปฏิกิริยาระหว่างกรดออกซาลิกกับโพแทสเซียมเปอร์แมงกาเนตที่อุณหภูมิต่าง ๆ
ใส่สารละลายกรดออดซาลิก 0.05

10 หยด และสารละลายกรดซัลฟิวริก 1.0

5 หยด ในหลอดทดลองขนาดเล็ก แล้วเติมสารละลาย
1. โพแทสเซียมเปอร์แมงกาเนต 0.005

ลงไป 10 หยด เขย่าและจับเวลาตั้งแต่เติมสารละลายโพแทสเซียมเปอร์แมงกาเนตลงไปจนกระทั่งสารละลายเปลี่ยนเป็นไม่มีสี
2. ทำการทดลองเช่นเดียวกับข้อ 1 แต่นำหลอดใส่สารละลายผสมระหว่างกรดออกซาลิกกับกรดซัลฟิวริกไปแช่น้ำที่ควบคุมอุณหภูมิให้คงที่ประมาณ

เป็นเวลา 5 นาที แล้วจึงเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต เขย่าและจับเวลา
3. ทำการทดลองเช่นเดียวกับข้อ 2 อีก 2 ครั้ง โดยควบคุมอุณหภูมิของน้ำเป็นประมาณ

และ

ตามลำดับ
เมื่อกรดออกซาลิกทำปฏิกิริยากับสารละลายโพแทสเซียมเปอร์แมงกาเนตจะเกิดปฏิกิริยาดังสมการ
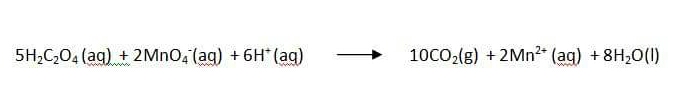
ปฏิกิริยาที่เกิดขึ้นนี้ จะสังเกตได้จากการเปลี่ยนสีของสารละลายจากสีม่วงเป็นสีชมพูอ่อน เนื่องจากเปอร์แมงกาเนตไอออน

สีม่วง เมื่อทำปฏิกิริยาจะเปลี่ยนไปเป็นแมงกานีส (II) ไอออน

ซึ่งเป็นสารสีชมพูอ่อน แต่ถ้าเจือจางมากจะได้สารละลายใสที่ไม่มีสี
จากการทดลองทำให้ทราบว่าที่อุณหภูมิสูงปฏิกิริยาเคมีเกิดได้เร็วกว่าที่อุณหภูมิต่ำ แสดงว่าอุณหภูมิมีผลต่าอัตราการเกิดปฏิกิริยาเคมี กล่าวคือเมื่ออุณหภูมิสูงขึ้นอัตราการเกิดปฏิกิริยาจะมีค่าเพิ่มขึ้น และเมื่ออุณหภูมิลดลงอัตราการเกิดปฏิกิริยาจะมีค่าน้อยลง ตามทฎษฎีจลน์อธบายได้ว่า เมื่ออุณหภูมิสูงขึ้น โมเลกุลของแก๊สจะเคลื่อนที่ด้วยอัตราการเกิดปฏิกิริยาเคมีจึงสูงขึ้น จากการคำนวณได้ผลว่าเมื่ออุณหภูมิเพิ่มขึ้น 10 องศาเซลเซียส อัตราการชนกันของโมเลกุลเพิ่มขึ้นเพียง 0.01 เท่า แต่ในทางปฏิบัติปรากฏว่าเมื่อเพิ่มอุณหภูมิขึ้น 10 องศาเซลเซียส อัตราการเกิดปฏิกิริยาจะเพิ่มขึ้น 2-3 เท่า นักเรียนคิดว่าเป็นเพราะเหตุใด
เราอาจะเขียนกราฟแสดงการกระจายพลังงานจลน์ของโมเลกุลของแก๊สที่อุณหภูมิต่าง ๆ ได้ดังรูป 6.10
.jpg) รูป 6.10 แสดงการกระจายพลังงานจลน์ของโมเลกุลของแก๊สที่อุณหภูมิต่างกัน
รูป 6.10 แสดงการกระจายพลังงานจลน์ของโมเลกุลของแก๊สที่อุณหภูมิต่างกัน
จากรูป 6.10 จะพบว่าพื้นที่ใต้กราฟทางด้านขวาของพลังงาน E ที่อุณหภูมิ

มีค่าน้อยกว่าที่อุณหภูมิ

แสดงว่าที่อุณหภูมิ

โมเลกุลที่มีพลังงานสูงกว่าE มีจำนวนน้อยกว่าที่อุณหภูมิ

โดยทั่วไปการชนกันที่ทำให้เกิดปฏิกิริยาเคมีเป็นการชนกันของโมเลกุลที่มีพลังงานสูง ซึ่งเมื่อชนกันแล้วทำให้พลังงานที่เกิดขึ้นมีค่าเท่ากับหรือมากกว่าพลังงานก่อกัมมันต์ นอกจากนี้การชนกันของโมเลกุลที่มีพลังงานสูงมาก ๆ กับ โมเลกุลที่มีพลังงานต่ำก็อาจทำให้เกิดปฏิกิริยาได้เช่นเดียวกัน แสดงว่าอุณหภูมิเป็นอีกปัจจัยหนึ่งที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
6.4.4 ตัวเร่งและตัวหน่วงปฏิกิริยาเคมี
จากการทดลองที่ผ่านมาช่วยให้ทราบว่าพื้นที่ผิวสัมผัส ความเข้มข้นของสารที่เข้าทำปฏิกิริยาและอุณหภูมิมีผลต่าอัตราการเกิดปฏิกิริยาเคมี ต่อไปจะศึกษาว่าเมื่อเติมสารบางชนิดปริมาณเล็กน้อยลงไปจะมีผลต่ออัตราการเกิดปฏิกิริยาหรือไม่ โดยศึกษาจากการทดลองต่อไปนี้
การทดลอง 6.5 ผลของสารบางชนิดต่ออัตราการเกิดปฏิกิริยาเคมี
ตอนที่ 1ผลของสารละลายแมงกานีส (II) ซัลเฟตต่ออัตราการเกิดปฏิกิริยาระหว่างสารละลายโพแทสเซียมเปอร์แมงกาเนตกับสารละลายกรดออกซาลิก
1.นำหลอดทดลองขนาดกลางมา 2 หลอด แต่ละหลอดใส่สารละลายกรดออกซาลิก 0.05

จำนวน 2

และสารละลายกรดซัลฟิวริก 1.0

จำนวน 1

2. นำหลอดที่ 1 มาเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต 0.005

จำนวน 2

เขย่าพร้อมทั้งเริ่มจับเวลาจนกระทั่งสารละลายเปลี่ยนเป็นไม่มีสี
3. นำหลอดที่ 2 มาเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต 0.005

จำนวน 2

และสารละลายแมงกานีส (II) ซัลเฟต 0.1

จำนวน 5 หยด เขย่าพร้อมทั้งเริ่มจับเวลาสารละลายเปลี่ยนเป็นไม่มีสี
ตอนที่ 2 ผลของโซเดียมฟลูออไรด์ต่ออัตราการเกิดปฏิกิริยาระหว่างเปลือกไข่กับสารละลายกรดแอซีติก
1. ใส่เปลือกไข่ที่ตากแห้งและบดละเอียดลงในหลอดทดลองขนาดกลาง 2 หลอด ๆ ละ 1 g
2. ใส่ผงโซเดียมฟลูออไรด์ 0.1 g ลงบนเปลือกไข่ในข้อ 1 เพียง 1 หลอด คลุกเคล้าให้ทั่ว
3. นำหลอดทดลองจากข้อ 1 และจากข้อ 2 มาเติมสารละลายกรดแอซีติก 0.5

หลอดละ 3

สังเกตการณ์เปลี่ยนแปลง
เมื่อเติมสารบางชนิดปริมาณเล็กน้อยลงไปแล้วทำให้ปฏิกิริยาเคมีเกิดได้เร็วขึ้น สารที่เติมลงไปนี้เรียกว่า ตัวเร่งปฏิกิริยาแสดงว่าในการทดลอง 6.5 ตอนที่ 1 แมงกานีส (II) ซังเฟต ทำหน้าที่เป็นตัวเร่งปฏิกิริยาระหว่างสารละลายกรดออกซาลิกกับสารละลายโพแทสเซียมเปอร์แมงกาเนต ส่วนสารที่เติมลงไปแล้วทำให้ปฏิกิริยาเคมีเกิดช้าลงเรียกสารนั้นว่า ตัวหน่วงปฏิกิริยา จากผลการทดลองตอนที่ 2 ปฏิกิริยาของสารในหลอดที่เติมโซเดียมฟลูออไรด์เกิดช้ากว่า จึงกล่าวได้ว่าโซเดียมฟลูออไรด์เป็นตัวหน่วงปฏิกิริยา จากผลการทดลองทั้งสองตอนสรุปได้ว่า ตัวเร่งปฏิกิริยาและตัวหน่วงปฏิกิริยามีผลทำให้อัตราการเกิดปฏิกิริยาเปลี่ยนแปลงได้
จากการศึกษาที่ผ่านมาได้เปรียบเทียบการเกิดปฏิกิริยาเคมีกับการเดินทางข้ามภูเขา และพลังงานก่อกัมมันต์เปรียบได้กับความสูงของภูเขา ถ้าภูเขาสูงมากคนที่มีกำลังมากพอเท่านั้นจึงจะผ่านไปได้ แต่เมื่อมีการใช้ตัวเร่งปฏิกิริยาซึ่งเปรียบเสมือนการเดินทางสายใหม่ที่ไปถึงจุดหมายปลายทางได้ อีกทั้งข้ามภูเขาไม่สูงมากหรือกล่าวได้ว่ามีพลังงานก่อกัมมันต์ของปฏิกิริยานั้นลดลงต่ำ ดังรูป 6.11 ทำให้คนที่จะเดินทางไปถึงจุดหมายปลายทางมีจำนวนเพิ่มม ากขึ้น นั่นคือโมเลกุลที่ชนกันแล้วมีพลังงานสูงกว่าพลังงานก่อกัมมันต์จะมีจำนวนมากกว่าเมื่อไม่มีตัวเร่งปฏิกิริยา จึงเป็นผลให้อัตราการเกิดปฏิกิริยาสูงขึ้น ความสัมพันธ์ระหว่างพลังงานก่อกัมมันต์ในกรณีที่มีและไม่มีตัวเร่งปฏิกิริยาแสดงได้ดังรูป 6.12.jpg)
รูป 6.11 ผลของตัวเร่งปฏิกิริยาต่ออัตราการเกิดปฏิกิริยาเคมี
(1).jpg)
รูป 6.12 เปรียบเทียบจำนวนโมเลกุลที่มีพลังงานสูงกว่าพลังงานก่อกัมมันต์ในกรณีที่มีและไม่มีตัวเร่งปฏิกิริยา
ในปฏิกิริยาที่มีตัวเร่งปฏิกิริยาอยู่นั้น เมื่อปฏิกิริยาสิ้นสุดแล้ว สมบัติของตัวเร่งปฏิกิริยาจะเป็นอย่างไร ศึกษาได้จากการทดลองต่อไปนี้
การทดลอง 6.6 สมบัติของตัวเร่งปฏิกิริยา
1.ใส่โซเดียมโพแทสเซียมทาร์เทรด 0.5 g ในหลอดทดลองขนาดกลาง เติมน้ำเดือด 5  เขย่าจนสารละลายหมด แล้วแบ่งสารละลายครึ่งหนึ่งใส่ในหลอดทดลองขนาดกลางอีกหลอดหนึ่ง
เขย่าจนสารละลายหมด แล้วแบ่งสารละลายครึ่งหนึ่งใส่ในหลอดทดลองขนาดกลางอีกหลอดหนึ่ง
2. เติมสารละลายไฮโดรเจนเปอร์ออกไซด์เข้มข้นร้อยละ 6 จำนวน 3  ลงในแต่ละหลอดพร้อมกัน
ลงในแต่ละหลอดพร้อมกัน
3.เติมสารละลายโคบอลต์ (II) คลอไรด์ 0.1  2-3 หยด ลงในหลอดทดลองที่ 1
2-3 หยด ลงในหลอดทดลองที่ 1
4.เขย่าหลอดทดลองทั้งสองเบา ๆ ตลอดเวลาสังเกตการณ์เปลี่ยนแปลง
สารละลายโคบอลต์ (II) คลอไรด์มีสีชมพู ขณะเกิดปฏิกิริยาจะเปลี่ยนเป็นสีเขียวและเมื่อปฏิกิริยาสิ้นสุดลงจะกลับเป็นสีชมพูเหมือนเดิมแสดงว่าขณะที่ปฏิกิริยาดำเนินไปตัวเร่งปฏิกิริยาจะเข้าไปมีส่วนร่วมในปฏิกิริยาด้วยโดยเปลี่ยนแปลงเป็นสารอื่นชั่วขณะหนึ่ง แต่เมื่อปฏิกิริยาสิ้นสุดแล้วจะกลับมาเป็นสารเดิม การที่จะทราบว่าตัวเร่งปฏิกิริยาเข้าไปมีส่วนร่วมในปฏิกิริยาอย่างไรนั้นจะได้ศึกษาในขั้นสูงต่อไป
ตัวเร่งปฏิกิริยามีประโยชน์มากทั้งในชีวิตประจำวันและในกระบวนการอุตสาหกรรม เช่น การย่อยอาหารในร่างกายใช้เอนไซม์หลายชนิดเป็นตัวเร่งปฏิกิริยาการผลิตแอมโมเนียใช้เหล็กเป็นตัวเร่งปฏิกิริยาในกระบวนการเติมไฮโดรเจนแก่สารอินทรีย์ใช้นิกเกิลเป็นตัวเร่งปฏิกิริยาและในกระบวนการแตกสลายไฮโดรคาร์บอนในการกลั่นน้ำมันใช้ซิลิคอนไดออกไซด์และอะลูมิเนียมออกไซด์เป็นตัวเร่งปฏิกิริยา การใช้ตัวเร่งปฏิกิริยาเพื่อช่วยให้ปฏิกิริยาเกิดเร็วขึ้น ต้องคำนึงถึงปัจจัยหลายอย่าง เช่น ความปลอดภัย ความยากง่ายในการแยกตัวเร่งปฏิกิริยาออกจากผลิตภัณฑ์ และราคาของตัวเร่งปฏิกิริยา
สำหรับตัวหน่วงปฏิกิริยา นอกจากโซเดียมฟลูออไรด์ซึ่งเป็นตัวหน่วงปฏิกิริยาระหว่างกรดแอซีติกับแคลเซียมคาร์บอเนตจากเปลือกไข่แล้ว ยังมีสารอื่นอีกที่ทำหน้าที่เป็นตัวหน่วงปฏิกิริยา เช่น ปฏิกิริยาการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ได้น้ำและแก๊สออกซิเจนดังสมการ
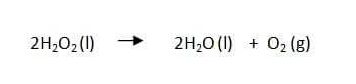
เมื่อเติมกรดไฮโดรคลอริกเจือจางหรือกลีเซอรอลลงไปเล็กน้อย จะทำให้ไฮโดรเจนเปอร์ออกไซด์สลายตัวได้ช้าลง
จากผลการทดลอง 6.1-6.5 และความรู้ที่ได้ศึกษามาแล้ว สามารถสรุปปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมีได้ดังนี้
1.ปฏิกิริยาเคมีส่วนใหญ่ เมื่อเพิ่มความเข้มข้นของสารตั้งต้นปฏิกิริยาจะเกิดเร็วขึ้น และเมื่อลดความเข้มข้นของสารตั้งต้นปฏิกิริยาจะเกิดช้าลง
2.สารที่มีพื้นที่ผิวมากจะเกิดปฏิกิริยาเคมีได้เร็วกว่าสารที่มีพื้นที่ผิวน้อย
3.การเพิ่มอุณหภูมิจะทำให้ปฏิกิริยาเกิดเร็วขี้นและการลดอุณหภูมิจะทำให้ปฏิกิริยาเกิดช้าลง
4. ตัวเร่งปฏิกิริยาจะทำให้ปฏิกิริยาเคมีเกิดเร็วขึ้นและตัวหน่วงปฏิกิริยาจะทำให้ปฏิกิริยาเคมีเกิดช้าลง
.jpg)
(1).jpg)
 เขย่าจนสารละลายหมด แล้วแบ่งสารละลายครึ่งหนึ่งใส่ในหลอดทดลองขนาดกลางอีกหลอดหนึ่ง
เขย่าจนสารละลายหมด แล้วแบ่งสารละลายครึ่งหนึ่งใส่ในหลอดทดลองขนาดกลางอีกหลอดหนึ่ง ลงในแต่ละหลอดพร้อมกัน
ลงในแต่ละหลอดพร้อมกัน 2-3 หยด ลงในหลอดทดลองที่ 1
2-3 หยด ลงในหลอดทดลองที่ 1





 จำนวน 10
จำนวน 10  ลงในหลอดทดลองขนาดใหญ่
ลงในหลอดทดลองขนาดใหญ่ จำนวน 10
จำนวน 10  ลงในหลอดทดลองในข้อ 1 เขย่าให้เข้ากัน สังเกตเครื่องหมายและจับเวลาผสมสารละลายเข้าด้วยกันจนกระทั่งเริ่มมองไม่เห็นเครื่องหมายกากบาท
ลงในหลอดทดลองในข้อ 1 เขย่าให้เข้ากัน สังเกตเครื่องหมายและจับเวลาผสมสารละลายเข้าด้วยกันจนกระทั่งเริ่มมองไม่เห็นเครื่องหมายกากบาท
 )
) ปริมาตรคงที่ 10
ปริมาตรคงที่ 10 

 )
) ลงในหลอดที่ 1 โดยไม่มีการเติมน้ำ ความเข้มของสารละลายในหลอดนี้ยังคงเป็น 0.3
ลงในหลอดที่ 1 โดยไม่มีการเติมน้ำ ความเข้มของสารละลายในหลอดนี้ยังคงเป็น 0.3  ส่วนหลอดที่ 2 นำสารละลายโซเดียมไทโอซัลเฟต 0.3
ส่วนหลอดที่ 2 นำสารละลายโซเดียมไทโอซัลเฟต 0.3  จำนวน 8
จำนวน 8  มาเติมน้ำให้เป็น 10
มาเติมน้ำให้เป็น 10  ความเข้มข้นของสารละลายในหลอดคำนวณได้ดังนี้
ความเข้มข้นของสารละลายในหลอดคำนวณได้ดังนี้ จำนวน 8
จำนวน 8  เป็นดังนี้
เป็นดังนี้

 ทำให้สารละลายมีปริมาตรรวม 10
ทำให้สารละลายมีปริมาตรรวม 10  ความเข้มข้นของสารละลายโซเดียามไทโอซัลเฟตในหน่วย
ความเข้มข้นของสารละลายโซเดียามไทโอซัลเฟตในหน่วย  เป็นดังนี้
เป็นดังนี้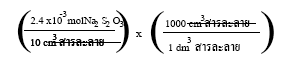

 สำหรับความเข้มข้นของสารละลายโซเดียมไทโอซัลเฟตในหลอดอื่นก็คำนวณได้ในทำนองเดียวกัน
สำหรับความเข้มข้นของสารละลายโซเดียมไทโอซัลเฟตในหลอดอื่นก็คำนวณได้ในทำนองเดียวกัน
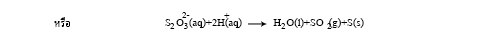


.jpg)
.jpg)

 10 หยด และสารละลายกรดซัลฟิวริก 1.0
10 หยด และสารละลายกรดซัลฟิวริก 1.0  5 หยด ในหลอดทดลองขนาดเล็ก แล้วเติมสารละลาย
5 หยด ในหลอดทดลองขนาดเล็ก แล้วเติมสารละลาย เป็นเวลา 5 นาที แล้วจึงเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต เขย่าและจับเวลา
เป็นเวลา 5 นาที แล้วจึงเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต เขย่าและจับเวลา และ
และ  ตามลำดับ
ตามลำดับ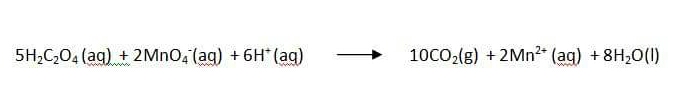
 สีม่วง เมื่อทำปฏิกิริยาจะเปลี่ยนไปเป็นแมงกานีส (II) ไอออน
สีม่วง เมื่อทำปฏิกิริยาจะเปลี่ยนไปเป็นแมงกานีส (II) ไอออน  ซึ่งเป็นสารสีชมพูอ่อน แต่ถ้าเจือจางมากจะได้สารละลายใสที่ไม่มีสี
ซึ่งเป็นสารสีชมพูอ่อน แต่ถ้าเจือจางมากจะได้สารละลายใสที่ไม่มีสี.jpg)
 มีค่าน้อยกว่าที่อุณหภูมิ
มีค่าน้อยกว่าที่อุณหภูมิ  แสดงว่าที่อุณหภูมิ
แสดงว่าที่อุณหภูมิ  โมเลกุลที่มีพลังงานสูงกว่าE มีจำนวนน้อยกว่าที่อุณหภูมิ
โมเลกุลที่มีพลังงานสูงกว่าE มีจำนวนน้อยกว่าที่อุณหภูมิ  โดยทั่วไปการชนกันที่ทำให้เกิดปฏิกิริยาเคมีเป็นการชนกันของโมเลกุลที่มีพลังงานสูง ซึ่งเมื่อชนกันแล้วทำให้พลังงานที่เกิดขึ้นมีค่าเท่ากับหรือมากกว่าพลังงานก่อกัมมันต์ นอกจากนี้การชนกันของโมเลกุลที่มีพลังงานสูงมาก ๆ กับ โมเลกุลที่มีพลังงานต่ำก็อาจทำให้เกิดปฏิกิริยาได้เช่นเดียวกัน แสดงว่าอุณหภูมิเป็นอีกปัจจัยหนึ่งที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
โดยทั่วไปการชนกันที่ทำให้เกิดปฏิกิริยาเคมีเป็นการชนกันของโมเลกุลที่มีพลังงานสูง ซึ่งเมื่อชนกันแล้วทำให้พลังงานที่เกิดขึ้นมีค่าเท่ากับหรือมากกว่าพลังงานก่อกัมมันต์ นอกจากนี้การชนกันของโมเลกุลที่มีพลังงานสูงมาก ๆ กับ โมเลกุลที่มีพลังงานต่ำก็อาจทำให้เกิดปฏิกิริยาได้เช่นเดียวกัน แสดงว่าอุณหภูมิเป็นอีกปัจจัยหนึ่งที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี จำนวน 2
จำนวน 2  เขย่าพร้อมทั้งเริ่มจับเวลาจนกระทั่งสารละลายเปลี่ยนเป็นไม่มีสี
เขย่าพร้อมทั้งเริ่มจับเวลาจนกระทั่งสารละลายเปลี่ยนเป็นไม่มีสี จำนวน 2
จำนวน 2  และสารละลายแมงกานีส (II) ซัลเฟต 0.1
และสารละลายแมงกานีส (II) ซัลเฟต 0.1  จำนวน 5 หยด เขย่าพร้อมทั้งเริ่มจับเวลาสารละลายเปลี่ยนเป็นไม่มีสี
จำนวน 5 หยด เขย่าพร้อมทั้งเริ่มจับเวลาสารละลายเปลี่ยนเป็นไม่มีสี หลอดละ 3
หลอดละ 3  สังเกตการณ์เปลี่ยนแปลง
สังเกตการณ์เปลี่ยนแปลง